Was passiert in den Zellen der Lunge bei Erkrankungen wie Hypertonie, Ödem oder Fibrose?
Das untersuchen Arbeitsgruppen am Walther-Straub-Institut für Pharmakologie und Toxikologie der Ludwig-Maximilians-Universität (LMU) München (Vorstand Prof. Dr. med Thomas Gudermann). Sie nehmen dafür spezifische Zielstrukturen der Zellen unter die Lupe: die Familie der TRP-Kationenkanäle.
TRP-Proteine sind Ionenkanäle, die für die Weiterleitung von elektrisch geladenen Teilchen (Ionen) sorgen. Ohne diese Kanäle könnten positiv geladene Kalium-, Natrium-, Magnesium- oder Calcium-Ionen die Zellmembran nicht überwinden. TRP-Kanäle spielen insofern eine wichtige Rolle bei der Wahrnehmung von Geschmack, Temperatur oder Schmerz.
Was passiert, wenn die Ionenkanäle blockiert oder aktiviert werden?
Wie wirkt sich das auf die Physiologie des Organsystems Lunge aus?
Das untersuchen die Gruppen zunächst im Mausmodell, später auch im Patienten. Die ersten Ergebnisse:
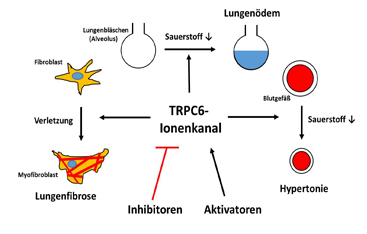
Die Blockade von TRPC6 könnte auch einen positiven Effekt bei Lungentransplantationen haben. Auf dem Transport vom Spender zum Empfänger wird das Organ, die isolierte Lunge, nicht durchblutet, was bei der folgenden Transplantation zu einer oft tödlichen Wassereinlagerung (Ödem) führt. Im Mausmodell aber konnten TRPC6-Blocker in isolierten Lungen genau diesen Schaden vermeiden. Würden sie während des Transports in Spenderlungen eingebracht, könnten tödlich verlaufende Transplantationen reduziert werden.
Eine weitere Entdeckung: Nach Verletzungen der Lunge wandern während der Reparaturprozesse sog. Myofibroblasten, die aus körpereigenen Fibroblasten gebildet werden, ins verletzte Gewebe ein. Eine massive Invasion dieser Zellen (Lungenfibrose) schädigt das Lungengewebe irreversibel und verhindert den Gasaustausch, so dass letztlich nur noch eine Lungentransplantation helfen kann. Während der Umwandlung von Fibroblasten in Myofibroblasten wird TRPC6-Kanal produziert, der diesen Prozess fördert. Mäuse ohne diesen Ionenkanal sind deswegen teilweise vor einer experimentellen Lungenfibrose geschützt.
Der nächste Schritt: Untersuchung weiterer Unterfamilien von TRP-Kanälen
Während die Arbeitsgruppen für TRPC6 bereits erste erfolgreiche Experimente mit Kanal-Aktivatoren und Inhibitoren (blockierenden Substanzen) durchführen konnten, fehlen für viele andere TRP-Kanäle der Lunge noch Wirkstoffe, die charakterisiert und getestet werden müssen.
Viele TRP-Kanäle wie TRPA1, TRPV4, TRPM2, TRPM6 und TRPM7 z.B. sind im Lungengewebe, dem Lungenepithel aktiv. Sie könnten als Sensoren für toxische Substanzen in der Lunge dienen. Die dafür relevanten Kanäle sollen nun identifiziert werden. Sie dienen dann als Zielstrukturen für Arzneimittel, die in Zukunft toxische Lungenschädigungen verhindern oder besser ausheilen lassen können.